בים המלח יש המון מלח. כ-35% מלח. אבל איזה מלח? מה זה בכלל מלח? מאיפה הגיע המלח? מהם יהלומי מלח?
מה זה מלח?
מלח זו תרכובת יונית. כלומר כל חלקיק מלח עשוי מיון חיובי (קטיון) ומיון שלילי (אניון) הנמשכים ונצמדים אחד לשני בכוח החשמלי. חלקיק מלח הוא נייטרלי.
המלח הנפוץ בעולם הוא המלח השולחני- נתרן כלורי (NaCl). הקטיון הוא הנתרן והאניון הוא הכלור (כלוריד). אבל ישנם עוד סוגים שונים של מלחים. השם של המלח תמיד מתחיל בשם של הקטיון ואחריו השם של אניון. קטיונים יכולים להיות אמוניום, סידן, ברזל, מגנזיום, אשלגן ועוד ואניונים יכולים להיות חומצת חומץ, חומצה פחמתית (קרבונט), חומצת לימון, ציאניד, פלואוריד, חנקה (ניטריט), זרחה (פוספט), גופרה וכו'.
ישנם מלחים שהם אכילים ויכולים להיות בכל חמשת הטעמים וישנם מלחים רעילים מאוד.
מסיסות- מה קורה למלח במים?
מלחים הרבה פעמים מתמוססים במים. מולקולת המים היא מולקולת קוטבית. הצד של החמצן הוא קוטב שלילי ואילו המימנים הם חיוביים. הכוח החשמלי שמפעיל כל צד של מולקולות המים הוא חזק מאוד (עוד תכונה שהופכת את המים לחומר מיוחד כל כך), ולכן המים מפרקים את המלח ליונים שממנו הוא מורכב. המים ממיסים מלח.
מלחים נבדלים זה מזה גם ברמת המסיסות שלהם.
הולכה חשמלית
המים מהברז מוליכים חשמל. גופים שמוליכים חשמל הם בעלי מטענים שיכולים לנוע בחופשיות. מים מזוקקים אינם מוליכים חשמל! מולקולת המים היא קוטבית אך היא נייטרלית. המלחים המומסים במים הם אלו שמעניקים למים את יכולת ההולכה החשמלית.
ניתן להדגים זאת יחסית בקלות: מה שצריך זו נורת לד קטנה ומים מזוקקים. מחברים מעגל חשמלי דרך מים מזוקקים- הנורה אינה נדלקת. מוסיפים קצת מלח למים והיא נדלקת.
למורים- מוזמנים לעשות את הפעילות בכיתתכם באמצעות דף הפעילות:
למדנו, כי מים אינם מוליכים חשמלית, וגם מלח אינו מוליך חשמלית אך תמיסת מלח בהחלט מוליכה!
מדידת מליחות ע"י מוליכות
על מנת לבדוק איכות מים, מודדים גם את המוליכות של המים. חשוב לבדוק את המוליכות של מקורות מים טבעיים כדי לדעת אם אין זיהום כלשהו או נזק סביבתי. ניטור מוליכות המים לאורך זמן ייתן אינדיקציה לשינויים סביבתיים ומידע על השפעת האדם על הסביבה.
סיפור מקרה- נחל בוקק
נחל בוקק הסמוך למלונות ים המלח, הנחל האיתן היחיד בדרומו של ים המלח ובית גידול יציב ונדיר באזור. נחל בוקק הוא מסלול פופולרי מאוד- הוא צמוד לכביש 90 ובמרחק הליכה מהמלון שלכם בים המלח. בנוסף, הוא קליל ממש ויש יחסית הרבה מים (די מלוחים). כשתלכו לשם בחופשה שלכם (ממליצה גם לזוגות וגם למשפחות!), התבוננו היטב במים ותיווכחו: כמעט ואין בע"ח במים. המים נקיים וצלולים בלי דגים, חלזונות וכד'.
נחל בוקק הוא נחל שמזוהם במלח. התחילו למדוד בנחל מליחות כבר ב- 1962. עד שנת 1995 המליחות הייתה כ0.05% ומשנה זו הנחל החל להזדהם מתמלחות תעשייתיות של מפעלי התעשייה במישור רותם שחלחלו לתת הקרקע. גם עכשיו הנחל עוד הולך ומתמלח ומליחותו מגיע לסדר גודל של 0.5%. זיהום זה פוגע בבע"ח ובצמחייה שבמים וכך הוא פוגע בכלל שרשרת המזון כולל בתיירות האנושית באזור. בנוסף, הזיהום פותח פתח להשתלטות חזקה יותר של מינים פולשים. בקיצור- יותר מדי מלח זה אסון למים! רשות הטבע והגנים אפילו ניסו להזרים מים מתוקים בנחל על מנת לדלל את המלח אך כל פרויקט הוא מסובך בסביבה כל כך מלוחה של ים המלח. הצינורות נסתמו שוב ושוב מהתגבשויות של קלציט ולא ראו שיפור.
מדידת מליחות מים היא פעולה מאוד חשובה גם עבור בריכות, אקווריומים, מי תהום, מי השקיה בחקלאות וכד'. אז איך מודדים מליחות?
מדידת מליחות היא אכן פעולה מסובכת, ישנן הרבה שיטות ולכל אחת היתרונות והחסרונות שלה. אחת מהדרכים ללמוד את המליחות היא ע"י מדידת המוליכות.
הקשר בין מוליכות למליחות
ככל שיש יותר מלח במים, יש יותר נושאי מטען חופשיים (היונים) ולכן מוליכות התמיסה גדלה. מצד שני, בשלב מסוים יהיו מספיק נושאי מטען כך שהוספת מלח למים כבר לא תשנה את המוליכות שלו.
אז מה הקשר בין המוליכות למליחות?
האמת שפעם אפילו עשיתי ניסוי קטן בעצמי. חיברתי מעגל חשמלי לסוללה וסגרתי אותו דרך מים בכוס כימית. הכנתי תמיסות עם ריכוז מלחים שונה, מדדתי את המתח ואת הזרם החשמלי בריכוזים השונים. בכל מדידה חילקתי את הזרם במתח וכך קיבלתי את הקשר בין מוליכות התמיסה באחוזים לבין המוליכות שלה בסימנס
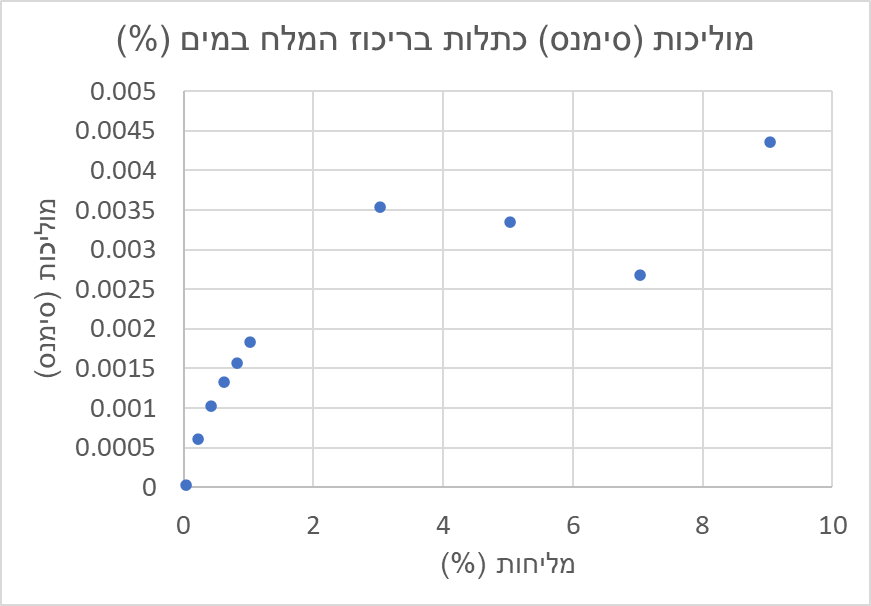
בניסוי זה יש המון בעיות. סביב האלקטרודות נוצרו תגובות כימיות שיצרו אי הומוגניות בתמיסה ואפילו בריכוזים הגבוהים יותר המים נהיו בצבע חלודי. המתח החשמלי בין האלקטרודות גורם לקיטוב במים ומחליש למעשה את השדה בין האלקטרודות. לכן מד מוליכות משוכלל מורכב מ-4 אלקטרודות, כך שיש תיקונים. בנוסף, ניתן לראות שמאחוזים בודדים של מלח כבר אין אפקט להגברת המליחות- יש כבר מספיק נושאי מטען. זו כנראה הסיבה שרוב מדי המוליכות פועלים רק בטווח של עד 1% המלח.
אז איך מודדים מליחות בנחל בוקק? דרך טובה למדוד מליחות בריכוזים נמוכים היא ע"י מד מוליכות. המוליכות כמובן תלויה גם בלחץ אוויר, טמפרטורה וסוג המלח ולכן מדידת מליחות של מקור מים טבעי היא פחות מדויקת מאשר תמיסה של מלח שולחני למשל. בכל מד מוליכות יש גם מד טמפרטורה שמכייל את המוליכות לפי הטמפרטורה.
יחידות המידה של מד מוליכות הן בדרך כלל מיקרוסימנס לס"מ או מיליסימנס לס"מ. המרחק הוא המרחק בין האלקטרודות שבד"כ הוא 1 ס"מ. בסיור ניתן למדוד את מליחות מי המעיין בעין פשח'ה ע"י מד מוליכות ובעזרת תמיסת כיול.
סוגי מים לפי מליחות
| טווח מליחות (%) | דוגמאות | |
| מים מתוקים | עד 0.05 | מי שתיה, עין גדי |
| מים מליחים | 0.05 – 3 | עין פשח'ה, עין פלוטית, עין בוקק |
| מים מלוחים | 3 – 5 | אוקיינוסים, ים תיכון, ים סוף |
| תמלחת | מעל 5 | ים המלח |
מקדם שבירה של תמיסת מלח- ההסבר למה ים המלח נראה שמנוני
מקדם השבירה של תמיסת מלח גדל עם המליחות.
מים מתוקים צפים על מים מלוחים כי המים המלוחים כבדים יותר (הסבר בהמשך הפוסט). כשהמים מהנביעות והנחלים זורמים לים המלח עם יוצרים "פלומה" של מים מתוקים שעובי של כס"מ אחד מעל המים המלוחים. כאשר אנחנו נכנסים לים המלח, אנחנו מערבבים את השכבות וזה נראה כמו שמן שמתערבב עם מים:
מדידת המליחות של מים באמצעות מדידת מקדם השבירה
בעזרת רפרקטומטר ידני מכני פשוט נתן למדוד את המליחות עד 10% מלח עם רגישות 0.1%. נבחר להשתמש ברפרקטומטר כדי למדוד מי ים או מים מליחים, בהם המליחות היא משמעותית.
תלות מקדם השבירה במליחות
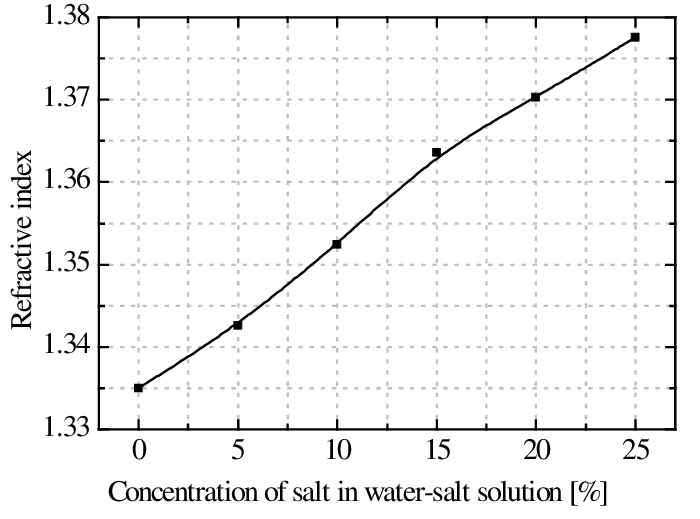
10.1109/EPEPEMC.2012.6397458.
גרף זה מראה את השינוי במקדם השבירה כתלות במליחות בטווח של 0-25% מלח. ניתן לראות שהשינוי הוא כמעט לינארי.
אם מקדם השבירה של מים משתנה כתלות במליחות אזי ניתן למדוד את המליחות ע"י מקדם השבירה, זאת נעשה בעזרת רפקטומר.
רפרקטומטר מלח
זה מכשיר מאוד מגניב הוא מכני לגמרי ולא צורך חשמל. שמים דגימה של מים על המנסרה ונותנים לאור להיכנס ולהשבר דרך הדגימה ולהתפקס בעין.

מקדם השבירה תלוי גם בטמפרטורה, ובתוך הרפרקטומטר יש מנגנון פיצוי על טמפרטורה שעובד בטכניקת דו מתכת: התקן המשמש לתרגום שינוי טמפרטורה לתנועה מכנית.
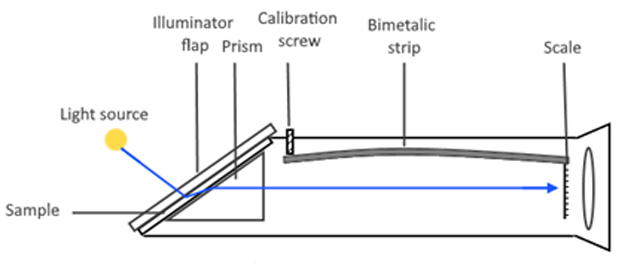
קרדיט: Rui Rodrigues

ים המלח
שאלת השאלות- מאיפה הגיע כל המלח לים?
ים המלח הוא נמצא בתוך בקעה, במקום הנמוך בעולם. לכן מים לא יוצאים מים המלח והוא אגן סגור, כלומר מים יוצאים ממנו רק ע"י אידוי. המים בטבע הם מים עם מלחים. כאשר המים מתאדים, המלח נשאר וכך מליחות ים המלח הולכת וגדלה. הרכב המלחים בים המלח שונה ביחס למי ים.
| הרכב מומסים עיקרי במי ים המלח (גרם לליטר) | ||
|---|---|---|
| ים המלח | מי ים רגילים | |
כלור (  ) ) | 208 | 19.4 |
מגנזיום (  ) ) | 39.2 | 1.27 |
נתרן (  ) ) | 39 | 10.7 |
| סידן ( Ca+2) | 17 | 0.42 |
אשלגן (  ) ) | 7 | 0.4 |
ברום (  ) ) | 5 | 0.07 |
גופרה (  ) ) | 0.5 | 3.6 |
דו-פחמה (  ) ) | 0.23[4] | 0.1 |
ניתן לראות כי בים המלח יש ריכוז מלח של פי 10 מהים כלומר מליחות של 35%-40%.
התגבשות מינרלים
בתמיסות מלח נוצרים תהליכים של התגבשות. סוג ההתגבשות תלוי במגוון משתנים כמו לחץ, קרינה, טמפרטורה, שינויים בדרגת הרוויה. הגביש יכול להיות גס או דק, יכול להיות שטוח, לבן ודומה לשלג או שקוף וקובייתי. אפשר לחקור סלעי מלח למטרות מגוונות כמו שחזור אקלימי, הידרולוגי וכד'.
אני התמכרתי לאיסוף של גבישי מלח. אפשר למצוא אותם בתוך הבוץ הסמוך לים או בתוך הבוץ שבתוך הים.
יהלומי מלח
גבישי מלח, אבני מלח נקראים בלעז "הליט" (Halite) והם בצורת קוביה.
גביש (קריסטל) הוא בעל סדר פנימי ארוך טווח העשוי ממבנה בסיסי הנקרא תא יחידה והמבנה חוזר על עצמו בכל הגביש. לא כל המוצקים הם גבישים למשל קרח או חתיכת מתכת עשוי מגבישים קטנים אבל אין סידור מחזורי של אטומים בכל המוצק. זכוכית היא גם לא גביש מכיוון שאין בה סידור מחזורי, אפילו לא מיקרוסקופי.
הגביש עשוי מיחידות שמרצפות את הגביש בתלת מימד ויש רק מספר מוגבל של מבנים גאומטריים כאלה שמתאימים עבור הריצוף כמו קובייה, תיבה, מנסרה משולשת, מעוינון, ומקבילון. פעמים רבות, הצורה של הגביש השלם היא אותה צורה של תא היחידה.
כללי פאולינג לסריג גבישי
צורת הגביש נקבעת לפי כללי פאולינג: (פיאון= גוף הנדסי התחום מכל צדדיו בחלקים מישוריים בצורת מצולעים הנקראים פאות)
- המרחק בין קטיון ואניון בפיאון תלוי בסכום של רדיוסיהם
- מספר ה"שכנים" בפאון תלוי ביחס שבים הרדיוסים של הקטיון והאניון
- סכום המטענים של הקטיונים סביב האניון שווה למטען האניון
- ככל שיש בפאון יותר צלעות ופאות משותפות, כך יציבות המבנה פוחתת.
- קטיונים קטנים עם מטען גבוה פחות חולקים אניונים.
- מספר יחידות עם מבנים שונים בתוך אותו גביש חייב להיות מינימלי
לפי הכללים הללו נקבע המבנה של תא יחידה במלח השולחני- קוביה.
והנה קצת תמונות של גבישי מלח טבעיים מים המלח:









אילו עוד תכונות יש לתמיסת מלח?
שינוי בנק' הרתיחה והקפאון
המלח מגדיל את כמות הקשרים הכימיים במים. המים קשורים לעצמם אבל גם ליוני הנתרן והכלור ולכן יש להשקיע יותר אנרגיה על מנת להרתיח את המים ולפרק את הקשרים הללו. בבישול, כשאנחנו מוסיפים מלח למים, אנחנו מגדילים את הטמפרטורה שלהם ברתיחה. העובדה הזו גם משיפעה על מאזן המים בים המלח: ככל שהמים מלוחים יותר כך האידוי יהיה נמוך יותר.
נק' הקפאון של מי מלח יורדת משמעותית. המלחים מפריעים למים להתגבש בצורה מסודרת. זו הסיבה שמתשתמשים במלח כדי להתיך שלג בארצות קרות. הוספת מלח לקרח תגרום להתכה של הקרח. לשם התכה דרוש החום הכמוס והוא נלקח מהסביבה של הקרח ולכן אפשר לקרר במהירות משהו באמצעות מלח וקרח- למשל על מנת להכין גלידה ב-10 דק':
הגברת שיתוך (קורוזיה)
שיתוך הוא תהליך טבעי שקורה כאשר מתכת מגיבה עם הסביבה שלה. הקורוזיה הורסת את המתכת. בתהליך יש החלפת אלקטרונים של המתכת עם הסביבה. מים, מאיצים את תהליך הקורוזיה מכיוון שבמים יש נושאי מטען- המלחים המומסים. ככל שיש יותר מלח התהליך קורה מהר יותר ולכם מחקר בים המלח הוא מאתגר במיוחד. מתכות רבות במכשירים חשמליים לא שורדות בסביבת ים המלח.
הגדלת צפיפות המים
מלח מקטין את הנפח של המים. המלח קושר את המים ליוני המלח וכך המים מצטמצמים. המסה של ליטר של מי ים המלח היא כ-1.25 ק"ג. אתם יכולים לנסות לעשות ניסוי:
שימו מלח במשורה ועל המלח מים. תעדו את נפח המים. כעת ערבבו את המלח ותעדו שנית את הנפח. שינוי הנפח הוא גם שינוי צפיפות: מי ים המלח הם צפופים ולכן המים המתוקים מהנביעות צפים עליהם. לכן אנחנו צפים במי ים המלח.
מדידת המליחות של מי ים המלח
מד מוליכות מודד עד 1% מלח. הרפרקטומטר מודד עד 10% מלח. אז איך ניתן למדוד את המליחות של ים המלח?
אפשר כמובן לאדות את כל המים ולשקול את המלח שנשאר. אך זה לוקח זמן רב.
אפשר לדלל את מי ים המלח בערך פי 4 ואז למדוד עם רפרקטומטר.
ואפשר להכין מד צפיפות (הידרומטר):
(מורים, הנה דף פעילות)
יש לכם משהו להוסיף? לתקן? משהו נוסף שתרצו לדעת? כתבו לי בתגובות


5 תגובות
מרתק!!! והתמונות מרהיבות
וואו! פשוט מרתק!
הכי אהבתי את זה שגביש מלח חייב להיות ריבוע, לפי כל התכונות שלו, כזה מגניב
נהדר!!! תודה על מאמר מלמד ומרתק!
כל כך פשוט וטוב.
הסברים קלילים ונרחבים, נהנתי לקרוא תודה !